102年2月(第248期)
新農藥開發之理論設計簡介
農業藥物毒物試驗所 林振文
壹 . 前言
目前全球人口數不斷的增加,然而耕作農地的面積有限,甚至因為氣候或汙染的因素,可用耕地不斷減少。為了能夠提高或維持充足的糧食供應,減少可避免的農作物損害是重要的一環。農藥無疑是對抗病蟲害的重要武器,超過半世紀以來農藥的發現幾乎都是直接用生物測試篩選出來,現在要篩出新的化合物更是難上加難。除了新化合物的發現趨緩之外,過程可謂是海底撈針,國外報告估計超過 14 萬個化合物中才會有一個成為可登記的農藥有效成分。近十多年來電腦輔助的藥物設計發展快速,其依循著藥物理論進行理論設計,成功改良許多化合物的活性並發展成為醫藥或農藥。在進入介紹理論設計前,先回顧藥物作用的一些理論基礎。
貳 . 藥物 - 受體交互作用原理
最早解釋藥物 - 受體交互作用的學說是 Emil Fisher 在 1894 年提出的鎖與鑰匙之概念,認為生物體內受體或酶等大分子猶如須要開啟的鎖,藥物或配體則作為鑰匙,精確的與鎖匹配。鎖與鑰匙之概念將受體和藥物分子視為剛性不易變動的結構,此學說能夠符合受體和藥物結合前後三維結構變化較小的情況,但對結合前後三維結構變化較大的情況無法解釋。於此, Koshland 於 1958 年提出誘導契合學說,認為受體是柔性分子而非固定不動的剛性結構,藥物或配體與受體結合會引起活性中心的三維結構變化,而形成互補性契合。誘導契合所發生的變化可以是單個胺基酸殘基位置的微小變動,也可能是整個蛋白質結構域的大範圍變化。近年來 Kumar 等學者於 1999 年提出受體構象群的穩定化學說,認為受體在溶液中已存在多種構象體,不同構象體間呈動態平衡。當藥物與受體的某個構象體結合,打破原來的平衡系統,導致平衡向某個結合構象移動。認為與配體結合的受體構象是預先存在的構象體,該結合過程使動態平衡移向該穩定之複合體。
參 . 蛋白質的柔性和可動性
隨著蛋白質 - 配體複合物結構數據的增加,人們發現一個蛋白質與不同的配體結合時,蛋白質的構象可能不同。例如綠棉夜蛾( Heliothis virescens ) 的蛻皮激素受體,當與 20- 羥基蛻皮激素或二醯基聯氨類殺蟲劑 -BYI6830 結合後,蛋白質結合腔之構象產生不同變化(圖 1 )。 Koshland 的誘導契合與 Kumar 的受體構象群的穩定化都是以蛋白質的柔性和結構鏈可移動性為前提,配體的結合使受體構象發生誘導作用,並由此產生級聯式的肽鏈移動,甚至發生構象的重大變化,例如蛋白質鏈的重新折疊。疏水鏈學說認為,蛋白質的某些結構域可產生瞬息穩定而固縮緊密的疏水單元( compact hydrophobic unit, CHU ),這些疏水單元間的互相識別,構成了新的重折疊構象。酶分子為了反覆履行催化作用,需要改變活性中心某些胺基酸殘基之空間位置,這是可以想像的。
肆 . 受體結構的理論設計
基於受體結構的理論設計是根據受體的三維結構,按照互補性原則來設計藥物分子之操作。例如依據酵素的活性部位三維結構來設計抑制劑,或基於受體結合表面設計受體調節劑。甚至利用信使 RNA 或 DNA 的特異序列和 Watson-Crick 配對原則設計反義寡核苷酸等都歸屬於藥物分子設計的互補性策略。蛋白質化學的進展已幫助足量高純度蛋白質的製備,並為解析蛋白質的三維結構提供必要的物質基礎。 X 光繞射和磁核共振技術已能夠迅速解析蛋白質結構,並利用這些靶蛋白質結構作為模板設計新的藥物分子。基於受體結構的理論設計在實施方法上可分為兩種不同的途徑:途徑一是按照受體結合部位的形狀和結構特徵,由化學基團或片段拼接產生與之互補的配體分子,這種如同按照鎖腔的構造製造鑰匙的操作,稱為全新分子設計( de novo design )。途逕二也是按照受體結合部位的形狀和結構特徵,將有機分子庫的化合物以三維結構逐一嵌合( docking )到受體結合腔來尋找適配的分子。
分子識別涉及分子間的作用力,理化性質與接觸表面的互補性,包括幾何形狀互補、電性互補和場效應互補,如相反電性基團間的相互吸引,靜電或偶極作用,或是在一定距離和適宜方向的氫鍵作用。受體對藥物的結合有時並非要求整個分子結構,而是必要的化學基團或片段。藥物分子結合蛋白質受體時通常並未完全包埋在蛋白質中,蛋白質的裂隙是藥物分子的出入口,藥物分子的親水性部位通常伸向外部水相的開口,而在結合腔內的取向和定位則主要取決於藥效團在空間的分布。即使配體的大部分原子直接與受體腔內的原子接觸,但配體有一部分仍曝露於受體外,配體的這一部分若引入親水性基團通常可改善溶解性和藥物代謝動力學性質。此外,具有不同化學結構骨架的藥物仍有可能與受體的同一部位結合,不同結構類型的化合物仍可能以不同化學結構為骨架來支撐相同的藥效團,在結合腔內有著相同的分布。例如雌二醇( estradiol )和己烯雌酚( diethylstilbestrol )雖然結構類型不同,但是具有類似的三維結構和藥效基團分布,因而在形狀與性質上對同一受體有相似的互補性。
受體標靶的三維結構信息是設計藥物分子的重要依據,蛋白質三維結構數據庫 Brookhaven PDB 是基於受體結構理論設計的受體結構主要來源。類似的蛋白質只要有胺基酸序列,可透過同源模建( homology modeling )的方法建立三維結構,但序列同源性應要在 40% 以上。小分子資料庫如 MDL 公司 MDL® Screening Compounds Directory 數據庫,庫中超過 200 萬種化合物都是商業上可以買到的化學品。其三維數據有些是用 X 光繞射或中子繞射化合物晶體所得,有些是用 2D 轉 3D 電腦軟體如 CONCORD 和 CORINA ,按照立體化學原則和化學拓樸結構參數、鍵型和手性信息將 2D 結構轉換成 3D 結構模型。
伍 . 分子嵌合的原理
藥物和受體的結合強度取決於結合的自由能變化( ΔG 結合), ΔG 結合與藥物 - 受體複合物的解離常數( Ki )的對數成線性關係。分子嵌合包括以下步驟: 1. 確定受體結合腔位置; 2. 定義結合腔的幾何形狀; 3. 確定結合優劣評分系統; 4. 分子嵌合; 5. 結果分析。配體結合往往發生在蛋白質腔穴或裂隙中,發現這些可能結合位置的算法很多,如 SPHGEN 程序將不同直徑之圓球填充到凹凸不平的受體腔或裂隙中,對於同一點通常選取可容納最大半徑的圓球,通常為 1.4~4.0 埃。結合腔內球集以照像軟片的負片形式表示結合腔的體積形狀,球與球中心之間的距離表示腔穴的形狀。配體分子以整體能量最優化的型式與受體表面接觸的過程,稱為分子嵌合。過程中比對結合腔內球心距離與配體原子間的距離,然後將配體定位於腔穴內,用評分函數評價交互作用;變換配體的方向,再計算得分,每個配體分子嵌合上萬次。嵌合過程中依序進行幾何形狀匹配,電性作用的匹配,使用 Force Field 模塊或勢能網格法( potential energy grid )計算配體與受體間相互作用之自由能變化。嵌合操作的後處理按照得分高低進行整理,如果得分函數可靠且嵌合操作合宜,得分較高的化合物甚至可以直接進行生物學評價。但在實際操作上往往需要對得分前 5% 的分子用分子圖形表現出來逐個考察,包括配體的構象、如何嵌合、嵌合之間有何相互作用等等,化學上要判斷分子的溶解性、化學穩定性、代謝與毒性、以及合成難易度等。此外為了減少後處理工作量,可按照化學結構分組,審核各組幾個代表性分子,如此可在較短時間內分析較多樣的化合物。
陸 . 基於配體的理論設計
X 光繞射尚不能解析膜蛋白的結構,雖然電子繞射可對膜蛋白結構提供信息,但解析力較低。在受體三維結構尚不清楚的情況下,從配體的化學結構出發進行分子設計是一重要方法。藥效團( pharmacophore )的概念是指一組化合物與同一標靶結合時,所需的特定原子和官能基的空間分布,這個概念的本質是從具有相同機理的不同化合物中,提出決定活性的共同結構特徵,而強調的是呈現活性的功能基團之性質和位置。例如以 Accelrys Discovery Studio 藥物設計軟體之藥效團工具建構一個可能的蛻皮激素藥效團模型(圖 2 )。組成整個藥效團的各個藥效基團在空間上的分布是離散非連續性的,它們的物化特徵及相對位置是非常重要的,至於藥效基團以何骨架支撐則無特別限制。對此近年來有新的發現,優勢結構的概念由 Evans 等首次提出,優勢結構與藥效團似乎是藥物分子的兩個互為依存互相補充的結構單元,是藥物化學和分子設計的重要內容。 Evans 的優勢結構是指可以衍生出對多種受體具有高親合作用的配體分子骨架。優勢結構是不同機理藥物間所共有的結構片段,是承載不同活性藥物的亞結構。一般來說,優勢結構不決定藥物的特定活性,當優勢結構連接某種結構特徵,使之符合特定藥效基團的空間排布和相對位置之要求,會產生特定的藥理活性。
柒 . 結語
拜電腦之賜,藥物的篩選有機會擺脫過去極耗資源的傳統試誤方式,進入理論設計的時代。近年來基於配體的理論設計已經能夠有效的運用藥效集團模型於藥物的改良與開發。另外,雖然基於蛋白質結構的理論設計具有全新有效成分開發之潛力,但相對來說仍未發展健全,主要是因為對於蛋白質本身的物理性質及立體結構未能完成掌握。不過,隨著生物資訊的快速擴充與電腦運算速度不斷邁進,近年來如癌症藥物 Raltitrexed ( Tomudex® ) 及愛滋病用藥 Raltegravir ( Isentress® ) 都是利用基於蛋白質結構分子設計成功開發上市的藥物,預期未來理論設計將能夠有效幫助新農藥成分之開發。

圖 1 綠棉夜蛾蛻皮激素受體與 20- 羥基蛻皮激素和二醯基聯氨類殺蟲劑 -BYI6830 之結合腔構象。採用 PDB ID:2R40 及 1R20 結晶構型,以 Accelrys Discovery Studio 藥物設計軟體進行圖形表示。綠色為 20- 羥基蛻皮激素結合的結合腔構象,黃色為 BYI6830 結合的結合腔構象。
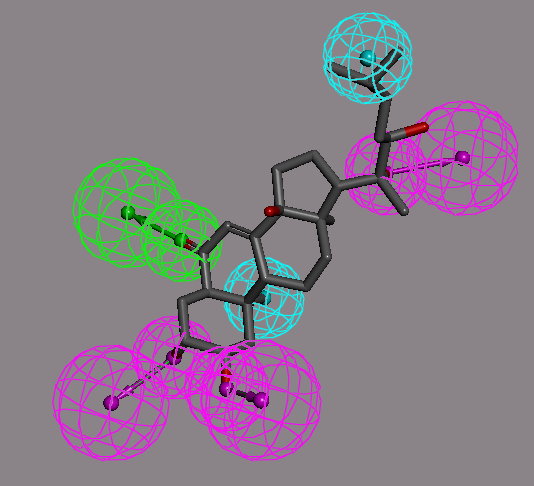
圖 2 蛻皮激素藥效團模型。此圖利用 Accelrys Discovery Studio 藥物設計軟體之藥效團工具( pharmacophore tool )建構一個可能的蛻皮激素藥效團模型,圖中青色球體代表疏水性團,粉紅色球體代表氫鍵的提供者,綠色球則代表氫鍵的接受者。其中之化合物為一個符合此藥效團模型的分子 ponasterone A 。

